De cada infección de la que nos defiende nuestro sistema inmune no solo salimos algo cansados sino, sobre todo, más viejos.
Las últimas investigaciones sugieren que la edad biológica puede ser mucho mayor que la natural en personas que han padecido múltiples infecciones víricas o que padecen una infección crónica.
En estos casos, no es raro que una persona con una edad cronológica -la del documento de identidad- de 40 años tenga un sistema inmune propio al de una persona de 60, lo que puede impactar profundamente en su calidad de vida y en el funcionamiento de su sistema inmune.
¿A qué se debe? ¿Cómo puede hacernos envejecer un virus?
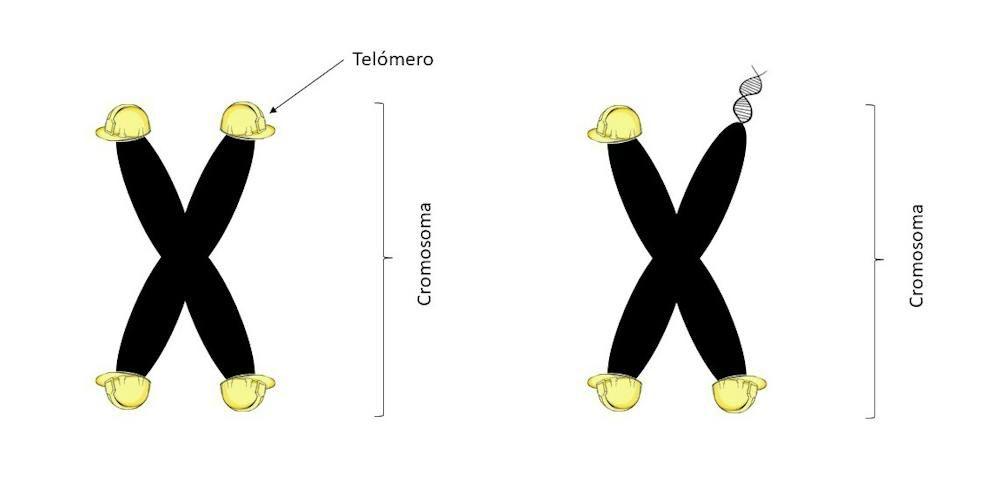
Para entenderlo, hay que empezar recordando que la información genética que heredamos de nuestros padres está guardada en nuestros cromosomas, es decir, en estructuras de ADN superempaquetado con cuatro brazos colocados en forma de X.
Y que para mantener estable este armazón de ADN, los cromosomas necesitan unas estructuras en sus extremos que funcionan a modo de cascos protectores, denominados telómeros.
La división implica desgaste
La palabra telómero, de origen griego, significa literalmente “parte final”.
Su función es impedir que los cromosomas se rompan o se dañen, ya que son más débiles en los extremos. Es como si los cromosomas estuvieran hechos de lana: sin esos cascos protectores, correrían el riesgo de deshilacharse y deshacerse.
Las células de nuestro cuerpo no son las mismas cuando nacemos que cuando morimos: a lo largo de la vida se van renovando mediante sucesivas divisiones en las que, a partir de una sola célula, se forman dos células hijas idénticas.

Cada división celular conlleva un pequeño desgaste de los telómeros, que se van haciendo más pequeños cada vez, algo que en la jerga conocemos como acortamiento de telómeros.
A partir de cierto número de divisiones, son tan pequeños que no pueden ejercer su función protectora y el cromosoma comienza a deshilacharse y perder su estructura. Cuando esto ocurre, las células pierden su capacidad para dividirse y desempeñar sus funciones.
En cierto modo, los telómeros actúan como relojes celulares capaces de medir cuántas veces puede dividirse una célula.
De hecho, lo normal es que las personas de mayor edad tengan los telómeros más desgastados que los más jóvenes.
Sin embargo, los telómeros no solo se acortan debido a la edad, sino que también influyen otros factores como la etnia, el sexo , el estrés, la dieta y la exposición a determinadas enfermedades.
Los efectos de las infecciones
Cuando las células del sistema inmune entran en contacto con un microorganismo dañino, se inicia un proceso de división y expansión masiva hasta formar una población numerosa suficiente para destruir al invasor.
Eso quiere decir que cada proceso infectivo da lugar a un ciclo de divisiones masivas de células inmunes, con el consiguiente desgaste de sus telómeros y el aumento de la probabilidad de entrar antes en lo que se conoce como estado de inmunosenescencia, es decir, un sistema inmune envejecido.

Cuantas más infecciones enfrentamos en nuestra vida, más se acortan los telómeros de las células que nos defienden y más envejece nuestro sistema inmune. De hecho, los expertos hablan de que existe una “senescencia inducida por virus”.
Concretamente, estudios con pacientes infectados con virus como el VIH, el virus de Epstein-Barr -que produce la mononucleosis- y el virus de la hepatitis C, entre otros, han demostrado un acortamiento de los telómeros del sistema inmune.
Además, recientemente se ha demostrado que los pacientes que han estado más graves debido a la covid-19 han sufrido un acortamiento de sus telómeros.
De ahí que, como adelantábamos al principio, la edad biológica pueda ser mucho mayor que la edad natural en personas que han padecido múltiples infecciones o que se enfrentan a una infección crónica.
Envejecimiento inmunológico
Con el acortamiento de telómeros y el envejecimiento del sistema inmune, las células pierden su capacidad para defendernos de las infecciones, por lo que existe un mayor riesgo de padecer enfermedades infecciosas.
Ese es el motivo por el que las personas mayores responden peor ante las infecciones y, lo que es más preocupante, también ante las vacunas, ya que para que una vacuna haga efecto necesita un sistema inmune que funcione correctamente.
También hay indicios de que el acortamiento de los telómeros impide que los tejidos dañados se puedan regenerar tras la infección mediante divisiones celulares, haciendo que una parte importante de los pacientes tengan secuelas o mayor riesgo de desarrollar otras patologías.
Más infecciones y enfermedades
Las consecuencias del envejecimiento inmunológico son múltiples.
Por un lado, se ha relacionado con una mayor susceptibilidad a infecciones respiratorias, urinarias, endocarditis infecciosa (infección del endocardio, membrana que recubre las cámaras del corazón) y septicemia (presencia de bacterias en la sangre), además de cáncer, alzhéimer y enfermedades autoinmunes.

Las enfermedades autoinmunes son enfermedades en las que el sistema inmune ataca a células de nuestro propio organismo sin ser estas dañinas: parece lógico pensar que un sistema inmune defectuoso tenga mayor probabilidad de “equivocarse” y atacar a quien no debe.
No hay duda de que las infecciones provocan un envejecimiento acelerado del sistema inmune, que conlleva una mayor predisposición a sufrir tanto enfermedades infecciosas como al desarrollo de otras patologías.
Esta interrelación entre infecciones y envejecimiento, a través del desgaste de telómeros, demanda investigaciones más profundas para intentar anticiparnos y diseñar estrategias que palíen su desgaste.
*Raquel Behar lagares es investigadora en el Centro Nacional de Microbiología, Instituto de Salud Carlos III.
*Amanda Fernández Rodríguez es investigadora en el Centro Nacional de Microbiología, Instituto de Salud Carlos III
*María Angeles Jiménez Sousa es investigadora en el Centro Nacional de Microbiología, Instituto de Salud Carlos III
Este artículo fue publicado originalmente en The Conversation y lo reproducimos bajo la licencia Creative Commons. Haz clic aquí para ver el original.
