¿Dónde empieza una historia?
Ésta, dado que se trata de algo que vino del suelo de uno de los lugares más remotos del planeta, quizás debe empezar con la erupción de tres masivos volcanes hace eones en el sur del Océano Pacífico, que formaron una isla de 163,6 km² la cual, a excepción de un área menor fecunda, es lava con una fina capa de suelo.
O de pronto el principio de esta historia debería ser un sueño; uno en el que un espíritu viajó en busca de un nuevo hogar para el legendario jefe supremo Hotu Matuꞌa y su gente, y encontró un triángulo con un hoyo (el cráter de un volcán) llamado “Te Pito ‘o el Kainga“, que significa “centro de la Tierra”.
Tras enviar 7 hombres a encontrarlo y recibir, a su regreso, la noticia de que era un lejano paraíso, Hotu Matuꞌa zarpó con dos barcos llenos de colonos. La civilización que prosperó, creó belleza y enigmas en esa mota de lava entre las olas que pusieron en el mapa a la que se conoce como Rapa Nui o Isla de Pascua.
Aunque tal vez es más adecuado darle inicio a esta historia con la curiosidad que despertó en un científico, cientos de años más tarde, el que los nativos no sufrieran de tétano, a pesar de que andaban descalzos en una tierra llena de caballos, las condiciones ideales para infectarse.
Fue por eso que el microbiólogo Georges Nógrády, uno de los 40 médicos y científicos que habían llegado de Canadá en diciembre de 1964 para estudiar la cultura, medio ambiente y enfermedades de ese excepcional lugar, dividió la isla en 67 parcelas y tomó muestras del suelo de cada una de ellas.
Sólo encontró esporas de tétano en una de las muestras, pero los frascos con pedacitos de territorio pascuense afortunadamente llegaron a manos de los científicos de la firma farmacéutica Ayerst, en 1969.
“Actividad fantástica”
Para Ajai Sehgal, director de Datos y Análisis de la Clínica Mayo, la historia empezó cuando era niño.
“Cuando tenía unos 10 años, iba con mi padre a su trabajo -en el laboratorio de Ayerst en Montreal- y hacía preguntas”, le contó a BBC Mundo. “No tenía las bases para comprender todo, pero sabía que se dedicaba al descubrimiento de medicinas y entendía lo que estaba tratando de hacer”.
Lo que estaban tratando y logrando hacer su padre, el microbiólogo Surendra Nath Sehgal, y sus colegas era aislar los microorganismos de la tierra de Isla de Pascua, coaccionarlos para que se reprodujeran y luego analizar las sustancias que producían.

Uno de ellos, la bacteria Streptomyces hygroscopicus, produjo un compuesto, un producto natural aislado en 1972 al que llamaron rapamicina, en honor a Rapa Nui, nombre que le dieron a la Isla de Pascua sus indígenas.
Descubrieron que eran muy bueno inhibiendo el crecimiento de hongos, pero había un problema.
“También era inmunosupresor así que dejaba la parte del cuerpo tratada sin defensas.
“Imagínate que tienes una infección fúngica en tu mano y te aplicas una crema de rapamicina: mata los hongos pero probablemente te dará una infección bacteriana”, explica Ajai.
Sin embargo, Sehgal intuyó su valor.
“Él sabía que tenía una actividad inmunosupresora muy agresiva, y también, que era una droga muy segura pues no se podía encontrar el nivel tóxico.
“Es decir: normalmente lo que se hace es darle a un ratón más y más y más dosis del medicamento hasta que muere, y así encuentran el nivel máximo seguro. Pero en el caso de la rapamicina nunca encontraron el nivel tóxico pues los ratones nunca morían”, aclara Ajai.
En ese momento, los inmunosupresores que se tenían “eran todos altamente tóxicos”.

Además, aunque pareciera contradictorio que algo que evita una defensa contra los tumores pudiera ser un fármaco anticanceroso probable, el dr. Sehgal observó que este compuesto parecía poseer propiedades novedosas pues podía impedir que las células se multiplicaran.
En una época en la que todas las quimioterapias mataban células vivas, contar con algo así podía ser muy beneficioso.
Sehgal envió una muestra del compuesto al Instituto Nacional del Cáncer (CIN) de EE.UU. donde notaron que tenía una “actividad fantástica” contra los tumores sólidos.
El trabajo en esa dirección estaba arrojando resultados prometedores cuando se suspendió abruptamente.
Desobediente
En 1982 Ayerst decidió cerrar su laboratorio de investigación de Montreal, y trasladar a unos pocos de sus científicos a sus instalaciones en Princeton, Nueva Jersey, Estados Unidos.
El doctor Sehgal era uno de ellos, pero la rapamicina no corrió con la misma suerte.
Era, sencillamente, un asunto de negocios. La compañía no vislumbraba un futuro lucrativo para ella como fármaco así que decidió ponerle fin al proyecto.
La orden fue deshacer todo, archivarlo y olvidarlo.
“Mi papá hizo todo lo contrario”, recuerda Ajai.
Sabiéndo que el cierre de las instalaciones de Montreal significaba que no tendría acceso a fermentadores a gran escala necesarios para producir rapamicina, el doctor Sehgal preparó un lote para llevárselo a Princeton.
“Lo metió en pequeños frascos de vidrio, se los llevó a la casa y los puso en el congelador de mi mamá, marcados con una etiqueta que decía: NO COMER, pues parecía helado”.
Ajai se enteró de la travesura de su papá cuando fue a ayudar a empacar para la mudanza a Princeton y le fue encargada la tarea de asegurarse de que su preciosa (y clandestina) carga llegara sin problemas al nuevo hogar.
“Yo tenía 20 años y era oficial de las Fuerzas Armadas de Canadá en ese entonces. Pero lo hice por mi padre.
“Metí todo en un contenedor de helado, compré hielo seco pues teníamos que desconectar el congelador para meterlo en el camión de trasteo, sellé todo con cinta aislante y le hice huecos porque cuando el hielo seco se derrite crea dióxido de carbono, y no quería que se convirtiera en una bomba, y así se fue”.
El plan dio resultado.
“El congelador llegó al sótano de su nueva casa en Princeton, sin explotar y con todas las muestras intactas, y ahí se quedaron durante unos 5 años“.
Un nuevo principio
A finales de la década de 1980, los transplantes de órganos ya estaban dejando de ser ciencia ficción. Pero el gran obstáculo seguía siendo el sistema inmunológico, que se activaba y atacaba la parte extraña al cuerpo, poniendo en riesgo la vida de los pacientes por rechazo.
Se necesitaba un inmunosupresor pero ¿recuerdas que los aprobados eran peligrosos y poco eficaces?
Para ese entonces, la empresa para la que trabajaba Sehgal había cambiado y él le llevó a los nuevos gerentes de la fusionada Wyeth-Ayerst la idea de explorar si la rapamicina podía ser la solución.
Desde el punto de vista de la farmacéutica, había llegado la hora de resucitar el proyecto: había mucho oro al final de ese arcoíris.
“‘Pero -le dijeron- ¿Cómo va a continuar su trabajo si todas las muestras fueron destruidas?’
“‘Quizás no’, les respondió.
“En ese momento él no tenía idea si las muestras que estaban en el congelador seguían vivas, si podía producir más rapamicina a partir de ellas: es como la masa madre para hacer pan, o el cultivo iniciador del yogur.
“En el laboratorio comprobó que habían sobrevivido. A partir de lo que mi papá guardó se crearon lotes nuevos para hacer los estudios“, cuenta Ajai.
Por si fuera poco…
Después de tantos años de creer pero no poder, en 1987 Sehgal tuvo los medios para volver a sacar a la luz lo que había sido desenterrado en Isla de Pascua.

Tras varios estudios clínicos exitosos, en 1999 el Comité Asesor de la FDA hizo una recomendación unánime para la aprobación de Rapamune, el inmunosupresor desarrollado por el dr. Sehgal y su personal que le ha reportado ganancias multimillonarias a Wyeth-Ayerst y, desde 2009, a Pfizer.
Pero Sehgal no quería únicamente desarrollar el potencial de la rapamicina como fármaco.
Había convencido al CIN de que reactivara su investigación sobre su efecto en los tumores malignos y quería entender cómo funcionaba… ¿por qué ‘congelaba el tiempo’ en el lugar que tocaba?
Con ese fin, envió muestras e información del compuesto a varios centros de estudio.
El ahora biólogo Daniel Sabatini -quien en 1992 estaba haciendo su doctorado en Medicina y Filosofía (MD-PhD)- se topó con uno de esos paquetes del doctor Sehgal, con una nota que decía: “¡Buena suerte!”.
Ciertamente la tuvo.
“Descubrió el mecanismo de acción del fármaco: cómo funciona”, dice Ajai.
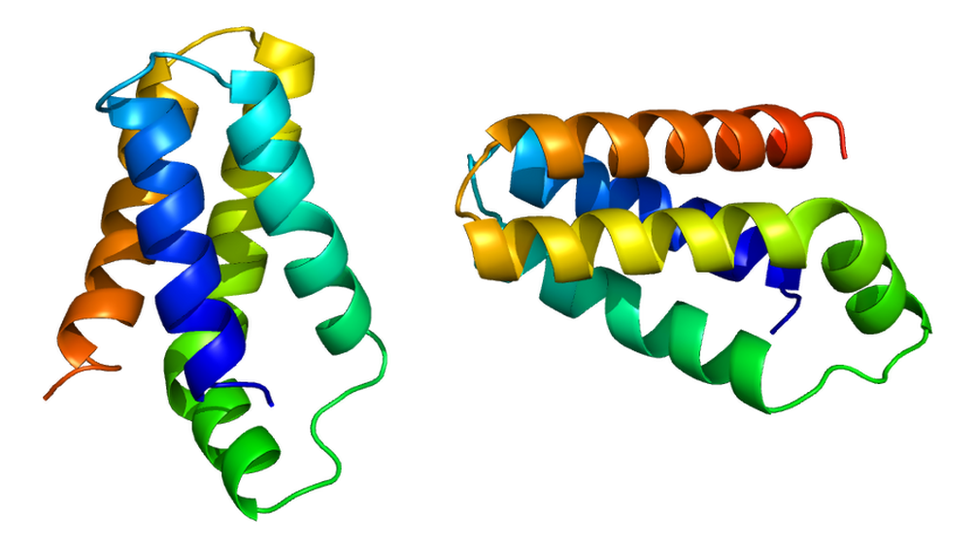
Y los esfuerzos para comprenderlo condujeron a que él y otros científicos independientemente identificaran una proteína conocida como mTOR, revelando aspectos fundamentales sobre nuestra naturaleza biológica.
¿Qué es eso???
“Imagínate una obra en construcción. El contratista general se ocupa de decirle a los plomeros, los carpinteros, los electricistas, los albañiles, etc. qué hacer. Si hay suficientes ladrillos y cemento, ordena que se levanten las paredes; si las tuberías no van a llegar hasta mañana, le dice a los plomeros que suspendan el trabajo.
“El mTOR hace eso por la célula. Es un sensor; detecta si hay nutrientes y le dice a la célula que crezca o no crezca“.
Es un indicador fundamental: si, por ejemplo, la división celular empieza sin los niveles óptimos de aminoácidos, glucosa, insulina, leptina y oxígeno para alimentar el proceso, la célula muere en vez de multiplicarse.
Lo que hace la rapamicina es engañar a las células del cuerpo para que piensen que hay pocos nutrientes cuando los hay, paralizando el crecimiento.
Y lo que los científicos están empezando a entender es que eso no es lo único que sucede.
Volviendo a la obra de construcción, mientras está marchando, hay bultos por aquí, basura por allá, pero si de pronto se tiene que suspender todo por falta de materiales, el contratista le dirá a los obreros que, mientras llegan, limpien y organicen el lugar.
Pues resulta que cuando la rapamicina engaña a mTOR, éste hace lo mismo con las células: les indica que se limpien, pues resulta que éstas van acumulando depósitos de deshechos que no eliminan y con el tiempo las hacen menos eficientes.
Eso es, básicamente, envejecer.
“La célula se limpia y se repara pues piensa que no tiene provisiones”, dice Ajai.
¿Que fue del papá de Ajai?
El doctor Sehgal recibió la admiración del mundo médico y el agradecimiento de millones a los que la rapamicina les había dado una vida más larga.
Supo de mTOR y la respuesta a lo que le intrigaba: por qué congelaba el tiempo. Pero no supo sobre la limpieza celular que propicia. Sin embargo, hasta en eso fue de cierta forma pionero, haciendo con su cuerpo lo que muchos investigadores harían -y siguen haciendo- con animales en los laboratorios.
En 1998, se le diagnosticó cáncer de colon metastásico en estadio IV después de una colonoscopia de rutina.
“Tras el primer año de quimioterapia que no podía tolerar -lo estaba matando- decidió suspenderla y empezar a tomar rapamicina.
“Él sabía que suprimía tumores; el tumor es una célula rebelde que crece sin control y la rapamicina se lo impide. Estaba experimentando en sí mismo pero le habían dado sólo seis meses de vida, así que no podía empeorar mucho más la situación”, señala su hijo.
“Se mejoró. De hecho, vivió una vida buena durante 4 años, pudo conocer a sus nietos y ellos a él. Y un día, en un viaje a India para dar conferencias, le dijo a mi madre: ‘Me siento bien, pero nunca sabré si es la rapamicina lo que me está manteniendo vivo a menos de que deje de tomarla’.
“Y eso hizo.
“En cuestión de 6 meses, el cáncer invadió todo su cuerpo y eso fue todo, se acabó.
“En su lecho de muerte me dijo: ‘lo más estúpido que hice fue dejar de tomar mi medicina’. Pero esa era su naturaleza. Era un científico y necesitaba saber.
“Además, estaba tratando de convencer a otros de que iniciaran los ensayos clínicos para el cáncer, y estaba emocionado pues, básicamente por lo que hizo, porque él documentó todo, así fue”.
“Trabajó hasta el final. El día antes de morir, estaba escribiendo un artículo en la cama abogando por las propiedades antitumorales de la rapamicina”.
El doctor Suren murió el 21 de enero de 2003.
Los usos de la rapamicina se siguen multiplicando, como inmunosupresor y en diferentes tipos de cáncer y otras enfermedades. En este momento, hay decenas de estudios en curso explorando su potencial para aminorar las consecuencias negativas de la vejez.
Recuerda que puedes recibir notificaciones de BBC Mundo. Descarga nuestra app y actívalas para no perderte nuestro mejor contenido.
